
Как сделать серную кислоту полезной? Показываем опыт
Бесцветные кристаллы без запаха, нелетучие. Эта соль устойчива только в сухом воздухе, а во влажном воздухе она разлагается на сульфат меди II и металлическую медь , также происходит разложение сульфата меди I , при попытке растворить её в воде. Материал из Википедии — свободной энциклопедии.












Медь сернокислая 5 водная — кристаллогидрат сульфата меди, в его составе 5 молекул кристаллизационной воды. Это неорганическая медная соль серной кислоты. В литературе может называться сульфатом меди 5-водным, пентагидратом сульфата меди, медным купоросом.
- Это химическое соединение, которое нашло очень широкое применение во многих отраслях промышленности. Что стоит знать об этом веществе и для чего оно применяется?
- Здесь нужно уточнить, какая серная кислота, разбавленная или концентрированная?
- Изобретение относится к способу выщелачивания оксида меди без использования серной кислоты. Способ включает пропитку руды, содержащей оксид меди, органическим незагрязняющим выщелачивающим агентом, представляющим собой водный раствор, состоящий из трикарбоновой кислоты С 6 Н 8 О 7 и воды H 2 O и имеющий рН в диапазоне от 1,0 до 5,0.













| 166 | Магний хлористый 6-водный представляет собой белые очень гигроскопичные, расплывающиеся на воздухе кристаллы, растворимые в воде и спирте. | |
| 446 | Effective date : | |
| 57 | Сульфат меди представляет собой неорганическое соединение, которое объединяет серу с медью. Сульфат меди может убивать бактерии, водоросли, корни, растения, улиток и грибки. | |
| 19 | Сульфат меди, также известный как сульфат меди, представляет собой неорганическое соединение с химической формулой CuSO4. Старые названия пентагидрата включают медный купорос, медный купорос, медный купорос и римский купорос. | |
| 351 | Взаимодействие серной кислоты с металлами. | |
| 95 | На кончике ложки черный порошок оксида двухвалентной меди. | |
| 191 | Первая мысль, которая приходит в голову после упоминания серной кислоты — опасность для людей и других живых существ. | |
| 273 | Реакция обмена между оксидом меди II и серной кислотой Практическая работа. |
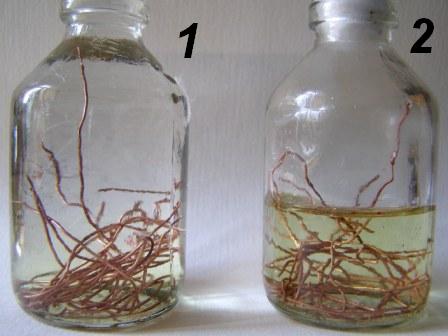
Серная кислота — одна из наиболее распространенных химических соединений, широко используемая в промышленности и лабораториях. Ее реакционные свойства известны многим, однако, взаимодействие серной кислоты с различными материалами может иметь свои особенности. Медь , ценный металл, широко используется в промышленности и строительстве. Этот металл отличается высокой электропроводностью и химической инертностью. Однако, несмотря на свою стабильность, медь может реагировать с некоторыми веществами и подвергаться окислению.







